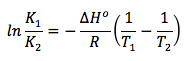La velocidad de una reacción es la rapidez con la cual los reactivos se transforman en productos, teniendo en cuenta ciertas condiciones. La velocidad de una reacción química no es constante, es rápida al principio y va disminuyendo a medida que los reactivos se gastan.
Velocidad media, cantidad (moles) de una sustancia formada o consumida durante una reacción química, en la unidad de tiempo. La unidad de tiempo será aquella que resulte apropiada a la velocidad de la reacción: micro segundos para explosivos, segundos o minutos para reacciones comunes.
A+B --------->C+D
FACTORES QUE AFECTA EL EQUILIBRIO QUÍMICO
Principio de Le Châtelier
A finales del siglo XIX, el químico francés Henry le Châtelier (1850- 1936) postuló que cuando en un sistema en equilibrio se modifica cualquiera de los factores mencionados, se afecta la velocidad de la reacción y el punto de equilibrio se desplaza en la dirección que tienda a contrarrestar el efecto primario de dicha alteración.
Concentración
Cuando la concentración de una de las sustancias en un sistema en equilibrio se cambia, el equilibrio varía de tal forma que pueda compensar este cambio. Por ejemplo, si se aumenta la concentración de uno de los reaccionan tes, el equilibrio se desplaza hacia la derecha o hacia el lado de los productos. Si se agrega más reactivos (como agregar agua en el lado izquierdo del tubo) la reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio.
Temperatura
La variación de equilibrio causada por un cambio de temperatura dependerá de si la reacción tal como esta escrita es exotérmica, o endotérmica.
Reacciones Exotérmicas
Si la reacción es exotérmica se puede considerar al calor como uno de los productos, por lo que al aumentar la temperatura el equilibrio se desplaza hacia la izquierda. A + B AB + calor Si se disminuye la temperatura, el equilibrio se desplazará hacia la derecha.
Reacciones Endotérmicas
Si la reacción es endotérmica, el calor se considera como un reactivo. A + B + calor AB Por lo tanto, si se aumenta la temperatura se favorece un desplazamiento del equilibrio hacia la derecha y si se disminuye, hacia la izquierda.
Presión
Si se aumenta la presión de un sistema en equilibrio, el equilibrio se desplazará de forma que disminuya el volumen lo máximo posible, es decir, en el sentido que alivie la presión. Como ejemplo, considérese el efecto de triplicar la presión en el siguiente equilibrio:
EFECTOS DEL CAMBIO DE LA CONCENTRACIÓN
Cambio de la concentración de una sustancia es algo que, incluso sin darnos cuenta, hacemos varias veces al día. Un ejemplo es la preparación, en una tarde muy caliente, un zumo de fruta y helado, de esos que vienen en botellas.
La receta es simple: en general, dos tazas de agua por cada taza de jugo concentrado. Esta es precisamente la adición de agua responsable de la alteración de la concentración de sabor. (Si no está familiarizado con la fusión plazo, le aconsejo que tome un texto leído en la densidad, concentración, molaridad y soluciones.)
Cambios de presión
Generalmente, cuando se modifica la presión de un sistema en equilibrio a temperatura constante, el sistema deja de estar en equilibrio y necesita reajustarse para volver a alcanzarlo. Del mismo modo, si modificamos el volumen también modificamos la presión y por tanto el sistema también deja de estar en equilibrio. Para modificar la presión de un sistema podemos introducir un gas inerte a volumen constante (lo cual no varía el equilibrio químico porque no varía las presiones parciales de los compuestos que intervienen en el mismo) o podemos variar al volumen del recipiente.
Si variamos el volumen del recipiente también varía la presión ya que: P·V = n·R·T
Son magnitudes inversamente proporcionales, de forma que al aumentar el volumen disminuye la presión y viceversa.
Considerando el siguiente equilibrio químico: N2(g) + 3H2(g) ⇔ 2NH3(g)
Se cumplirá que:
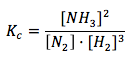
Si reducimos el volumen a la mitad, se duplicarán las concentraciones de las especies con respecto a las del equilibrio. Así:
1 [N2] = 2[N2]e
2 [H2] = 2[H2]e
3 [NH3] = 2[NH3]e
variación de la temperatura
Como hemos visto en el apartado 2 de teoría de equilibrio químico, relativo a la constante de equilibrio Kc, el valor de esta constante depende de la temperatura. Por tanto, cuando en un sistema en equilibrio se modifica la temperatura, deja de estar en equilibrio porque se modifica el valor de la constante de equilibrio. Así, a una temperatura T1 la constante vale K1, y a una temperatura T2, la constante vale K2. La relación entre estas magnitudes viene dada en la denominada ecuación de Van’t Hoff:
ΔHo: entalpía estándar de la reacción
R: constante de los gases ideales
K1: constante de equilibrio a la temperatura T1
K2: constante de equilibrio a la temperatura T2
Los catalizadores.
Existen sustancias que funcionan como catalizadores positivos, al favorecer la velocidad dereacción( H2 y O2, en un matraz tapado, no pasa nada, pero si se coloca un poco de musgode platino, a los pocos minutos la mezcla gaseosa se inflama, y hay explosión: los dos gasesse han combinado, con la producción de agua. El platino catalizó la reacción positivamente,acelerando la reacción). Y catalizadores negativos, que disminuyen la velocidad de lareacción (acetanilida C6H5.NH.CO.CH3 que se adiciona a peroxido de hidrógeno H2O2 para disminuir o retardar su descomposición (en H2O + O). Los catalizadores sonsustancias que no son consumidas durante las reacciones.La velocidad de reacción, se determina al medir la cantidad de un reactivo agotado, o lacantidad de producto formado, en un determinado tiempo:Velocidad de reacción = cambio en concentración.
Clases de equilibrio
Homogéneo
Consta de una fase única, bien sea gaseosa o líquida. Todos los componentes (reactantes y productos) se hallan en la misma fase.
Heterogéneos
Todos sus componentes (reactantes y productos) pueden encontrarse en dos o más estados. No se les pueden aplicar la ley atracción de masas, ya que sus moléculas se mueven libre desordenadamente, pero si se considera solo la fase en que las concentraciones de los reactivos son variables, si se pude aplicar esta ley.
Moleculares:
Es cuando los sistemas implican moléculas, generalmente, en estado gaseoso. En solución: Cuando el sistema se encuentra en disolución acuosa.
BIBLIOGRÁFIA: http://cienciasenbachillerato.blogspot.com.co/2011/05/velocidad-de- reaccion-y-equilibrio.html